Une récente étude sud-africaine publiée en fin novembre 2025 dans le Journal of the Colleges of Medicine of South Africa démontre la faisabilité du dépistage automatisé de la rétinopathie diabétique (RD) par intelligence artificielle dans les contextes à ressources limitées. L’étude, menée par Margaretha M. Roux, James C. Rice et Jonel Steffen de la Division d’Ophtalmologie de l’Université du Cap, fournit des données intéressantes.
Contexte et Enjeux
La rétinopathie diabétique demeure l’une des principales causes de cécité, affectant environ un tiers des personnes atteintes de diabète. Environ 10% des patients diabétiques développent une RD menaçant la vision, telle que la RD proliférante ou l’œdème maculaire diabétique. Dans les contextes à ressources limitées, comme ceux rencontrés dans de nombreux pays africains, le dépistage efficace de cette complication reste un défi majeur : pénurie d’ophtalmologues, coûts élevés pour une frange de la population et accès limité aux services de diagnostic. Ce qui attiré notre attention sur cette étude.
L’intelligence artificielle offre une solution prometteuse pour automatiser le processus de dépistage et améliorer l’accès aux soins ophtalmologiques. Cependant, les données de faisabilité dans des contextes réels restaient jusqu’à présent limitées.
Méthodologie
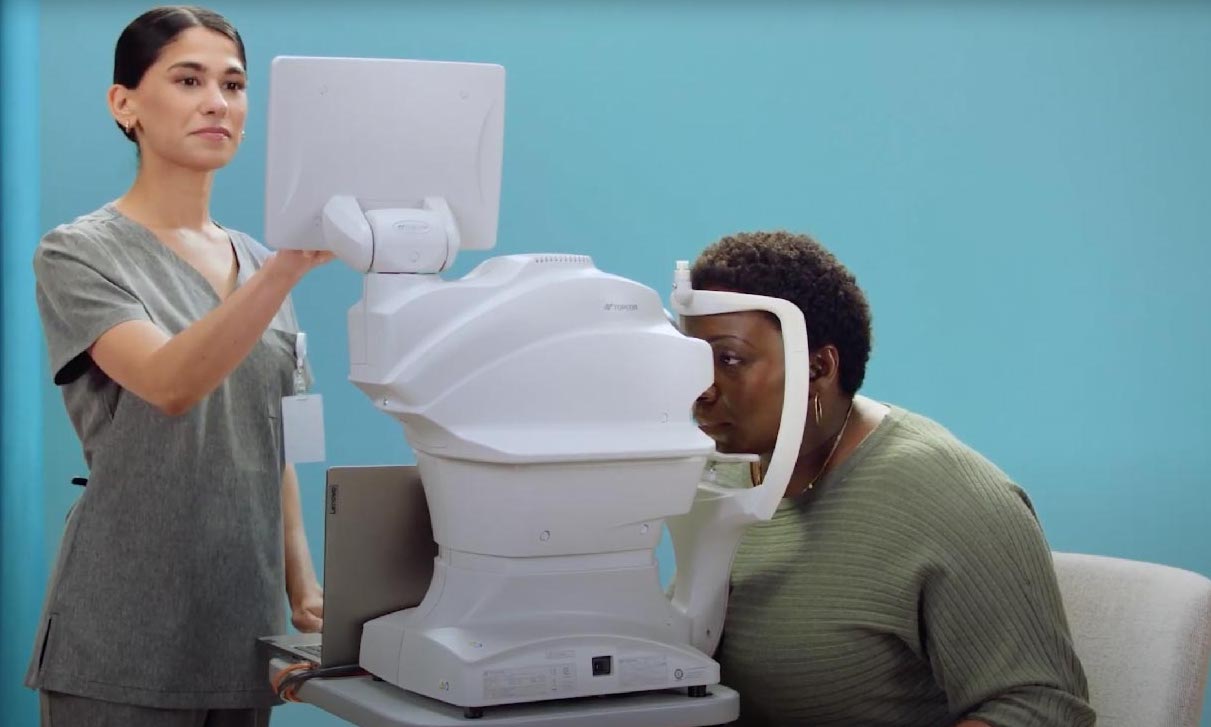
Il s’agit d’une étude prospective de faisabilité menée entre avril et juillet 2022 auprès de patients diabétiques adultes consultant à la clinique d’endocrinologie d’un hôpital public du Cap. Les patients ont subi un dépistage de la RD utilisant un système d’IA autonome, le LumineticsCore®. Le système classifiait la RD selon deux catégories principales :
- RD non-référençable : absence de RD ou RD non-proliférante légère
- RD référençable : RD non-proliférante modérée ou plus sévère
Les patients présentant des images non gradables ou une RD référençable détectée par l’IA étaient orientés vers un ophtalmologue pour confirmation et prise en charge.
Résultats Clés
L’étude a inclus 62 patients. La durée moyenne du dépistage par l’IA était de 11,7 minutes par patient. Ce temps s’est avéré acceptable pour une intégration en clinique. 39 patients sur 62 (62,9%) ont présenté des images initiales non mydriasées non gradables. Même après dilatation pharmacologique, 19 patients sur 62 (30,6%) avaient des images restant non gradables. La cataracte s’est identifiée comme la principale cause d’images non gradables
Efficacité Diagnostique
55 patients sur 62 (88,7%) ont été orientés vers l’ophtalmologie, dont 36 patients (58,1%) pour RD référençable détectée par l’IA et 19 patients (30,6%) pour images non gradables.
L’évaluation ophtalmologiste a identifié que 8 patients sur 62 (12,9%) requéraient un traitement pour RD. Les 8 patients ayant nécessité un traitement présentaient une RD non-proliférante sévère ou une RD proliférante et ont reçu une photocoagulation pan-rétinienne ; deux patients ont également reçu un traitement complémentaire. La cataracte était la principale cause d’images ininterprétables par l’IA.
Implications Cliniques et Recommandations
L’étude révèle deux défis importants pour l’implémentation durable du dépistage par IA en contextes de ressources limitées :
- Le fardeau élevé d’orientation initial : un taux de référence de 88,7% risquerait de surcharger les services ophtalmologiques déjà débordés, sans adaptation du parcours
- Les images non gradables : avec 30,6% d’images restant non gradables après dilatation (principalement en raison de la cataracte), l’intégration directe du système sans protocoles additionnels pourrait ne pas être viable
Les auteurs proposent des adaptations essentielles pour assurer une implémentation durable dans les contextes à ressources limitées :
- Relever le seuil d’orientation en ciblant uniquement la RD menaçant la vision (RD non-proliférante sévère, RD proliférante et/ou œdème maculaire diabétique), plutôt que toute RD modérée ou plus sévère
- Intégrer des protocoles de gestion de la cataracte : identifier les patients présentant des opacités de cataracte non gradables et les orienter pour extraction de cataracte en priorité, afin d’améliorer la qualité des images au dépistage ultérieur
- Former et impliquer le personnel local pour améliorer la technique de capture d’images et réduire les images de mauvaise qualité
Référence:
Roux MM, Rice JC, Steffen J. Feasibility of automated artificial intelligence screening for diabetic retinopathy in a resource-limited setting. Journal of the Colleges of Medicine of South Africa. 2025;3(1).
Étude originale disponible ICI
Dr Euclide OKOLOU